Кормовой белок сои: плохой или хороший? Биотрансформации

Хорошо ли иметь белок в виде только аминокислот или в виде пептидов? Ответ очевиден - лучше иметь оптимальную смесь, т.к. получив только аминокислоты организм будет вынужден заново создавать пептиды и белки, которые пойдут на нужды организма. Поэтому лучше дать белок в том виде, который будет претерпевать минимум трансформаций. Входящий белок обычно имеет иную структуру – обратную – много белков, мало пептидов и свободных аминокислот. С целью его трансформации проводят процесс ферментирования, с помощью которого получают оптимальный по фракционному составу белок:

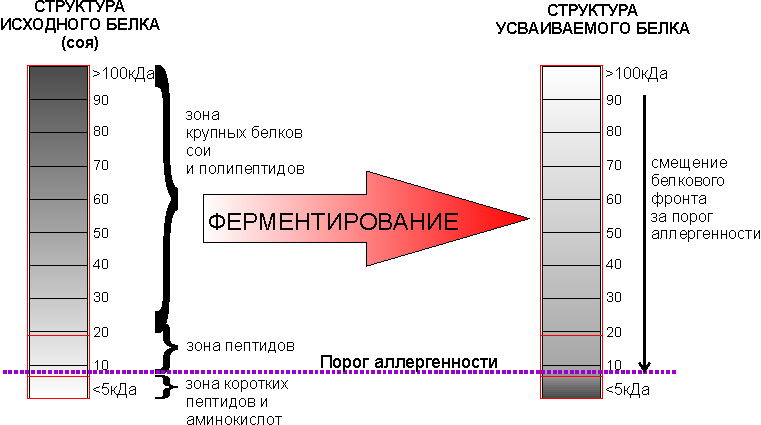
При этом спектры включают белки с молекулярной массой от 4-х до 97-ми kDa.






